Метални химична връзка 1
предназначение
- Дайте идея за химичната връзка на метала.
- Научете се да пишете формация схема на метален връзката.
- Познати с физичните свойства на метали.
- Научете се да се направи ясно разграничение между видовете химични връзки.
цели на урока
- Научете се как да си взаимодействат метални атоми
- Определя как да повлияе на метален връзка, образувана от свойствата на материалите
Ключови термини:
- Електроотрицателност - химично свойство на един атом, който е количествен характеристика на способността на атом в молекулата да привлича електрони споделени двойки.
- Химично свързване феномен на взаимодействие на атоми, поради припокриването на електрона облаци взаимодействащите атоми.
- Метални връзка - връзка между атоми в метали и йони, образувани в резултат на обмена на електрони.
- Ковалентна връзка - химичната връзка, образувана от припокриващи двойки на валентните електрони. Осигуряване на обратна връзка електрони се наричат общо електронна двойка. Има 2 вида полярна и не полярна.
- Йонна връзка - химичната връзка, която се образува между nemetalov атома, където общата електронна двойка отива атома с по-голям Електроотрицателност. В резултат на атомите са привлечени като противоположно натоварени органи.
- Водородна връзка - химичната връзка между електроотрицателна атом и водороден атом Н, свързан ковалентно към друг електроотрицателна атом. Както електроотрицателна атоми могат да служат N, О или F. водородни връзки могат да бъдат вътрешномолекулни или междумолекулни.
Метални химична връзка
Определи елементите, които са станали не на "до" .Pochemu?
Са Fe P K Al Mg Na
Кои са елементите на периодичната таблица, се наричат метали?
Днес ние знаем кои имоти са с метали, и те зависят от връзката, която се образува между yonami метали.
Първо, нека да mestoraspolazheniya метали в периодичната таблица?
Метали, както всички знаем, има не обикновено под формата на изолирани атоми, както и под формата на парче, блок или метални изделия. Изяснете, който събира на металните атоми в целия екран.

Фиг. 1. Gold.
На примера виждаме парче злато. И между другото уникален метал е злато. С коване на чисто злато може да бъде фолио с дебелина от 0,002 mm! лист фолио nonchayshy почти прозрачен и има зелен оттенък лумен. В резултат на самородно злато с размерите на кибритена кутия може да се получи тънък фолио, което ще обхване района на тенис корт.
Химически, всички метали се характеризират с лекота на връщане на валентните електрони, и следователно образуването на положително заредени йони и да бъдат само положителна окисление. Ето защо металите са в свободно състояние Studio Network. Обща характеристика на метали атоми са големи размери по отношение на nemetalam. Външно ellektrony намира на големи разстояния от ядрото и затова слабо, свързани с нея, така че лесно да влезе.
Атомите на големи количества метали на външното ниво имат малко изненадващо брой електрони - 1,2,3. Тези електрони лесно отделени и метални атоми стават йони.
Me0 - н д ⇆ Men +
атоми на метал - E-Ext. орбита ⇆ метални йони
Така peremeschatsya може да излезе електрони от един йон към друг Т.е. стане свободен, и като ги направи в един tseloe.Poetomu Оказва се, че всички електрони излизам evlyaetsya като цяло, тъй като е невъзможно да се разбере как ellektron принадлежи на метални атоми.
Електроните могат да бъдат обединени с катиони, като се образуват временно атома, от които след това конст отделят електрони. Този процес протича непрекъснато и без прекъсване. Оказва се, че обемът на металните атоми стане йони непрекъснато и обратно. Когато този малък брой общи електрони свързва голям брой метални атоми и йони. Но е важно, че броят на електроните в метала е равен на общия заряд на положителните йони, т.е. се оказва, че като цяло, метала остава електрически неутрални.
Този процес е представен като модел - металните йони са в облак от електрони. Такъв електронен облак, наречен "електронен газ".
Ето, например в тази картина виждаме как elektronchiki ход сред nepodvizhnyhyonov вътре-кристална решетка от метал.
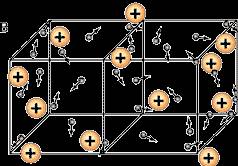
Фиг. 2. Движението на електроните
Сега ние можем да напише определение: металния връзка - връзка с метали между атоми и йони се образуват чрез споделяне на електрони.
метален връзка е не само чисти метали, но също характеристика на смеси от различни метали, сплави в различни състояния на агрегация.
метален връзка е важно и определя основните свойства на метали
- проводимост - E-случайно движение на насипния метал. Но когато една малка разлика в потенциалите. електроните се движат правилно. С по-добра проводимост метали са Ag, Cu, Au, Al.
- еластичност
Връзките между металните пластове не са много значими, тя позволява да се движат слоевете под товар (деформира метала, без да го счупи). Най деформируеми метали (мека) Au, Ag, Cu.
- метален блясък
Electron газ отразява почти всички светлинни лъчи. Ето защо толкова много чисти метали блестят и често имат senryu или бяло. Метали са най-добрите рефлекторите Ag, Cu, Al, Pd, Hg
Упражнение 1
Избор на съединения, които имат формула
а) полярен ковалентна връзка: Cl2, KCI, NH3, O2, MgO, CCl4, SO2;
б) с йонна връзка: HCI, KBr, Р4, H2S, Na2O, CO2, CAS.
Упражнение 2
Стискайте ненужните:
а) CuCl2, Al, MGS
б) N2, HCI, O2
а) Са, СО2, Fe
ж) MgCl2, NH3, Н2
Интересно е да се знае, че ...
Натриев метал. литиев метал, и други алкални метали варират цвят пламък. Метални литий и негова сол --krasny придават цвят пламък, метален натрий и натриев - жълт, метален калий и негови соли - пурпурни и рубидий и цезий - също лилаво, но по-лек.

Фиг. 4. Част от литиев метал
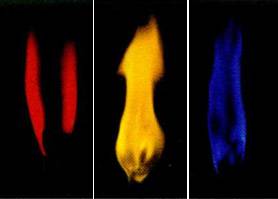
Фиг. 5. оцветяване метали пламък
Литий (Li). литиев метал като метален натрий, алкален метал. И двете са разтворими във вода. Натрий, разтворен във вода образува сода каустик-много силна киселина. При разтваряне на алкални метали във водата много топлина и газ (водород). Такива метали, е желателно да не се докосват, защото можете да се изгорите.
Позоваването
Редактиран и изпратен Lisnyak AV
Над урока работи:
Повдигне въпроса за модерно образование, за да изразят идея или за решаване на постоянния проблем, можете да по време на Форума Образователен. където международно образование ще се качат със свежи мисли и действия. Чрез създаването на блог, вие не само ще засили статута си на квалифициран инструктор, но и да има значителен принос за развитието на бъдещото училище. Guild Лидерите образование отваря врати към професионалисти от най-висок ранг, и приканва да си сътрудничат за създаването на най-добрите училища в света.